Как сделать 3 раствор
Растворы процентной концентрации
Приготовление растворов. Раствором называют однородные смеси двух или более веществ. Концентрацию раствора выражают по-разному:
в весовых процентах, т.е. по количеству граммов вещества, содержащегося в 100 г раствора;
в объемных процентах, т.е. по количеству единиц объема (мл) вещества в 100 мл раствора;
молярностью, т.е. количеством грамм-молей вещества, находящегося в 1 л раствора (молярные растворы);
нормальностью, т.е. количеством грамм-эквивалентов раствореного вещества в 1 л раствора.
Растворы процентной концентрации. Процентные растворы готовят как приблизительные, при этом навеску вещества отвешивают на технохимических весах, а объемы отмеривают измерительными цилиндрами.
Для приготовления процентных растворов пользуются несколькими приемами.
Пример. Необходимо приготовить 1 кг 15%-ного раствора хлористого натрия. Сколько необходимо для этого взять соли? Расчет проводится согласно пропорции:
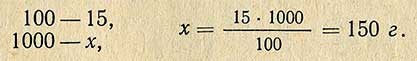
Следовательно воды для этого необходимо взять 1000-150 = 850 г.
В тех случаях, когда надо приготовить 1 л 15%-ного раствора хлористого натрия, необходимое количество соли рассчитывают другим способом. По справочнику находят плотность этого раствора и, умножив ее на заданный объем, получают массу необходимого количества раствора: 1000-1,184 = 1184 г.
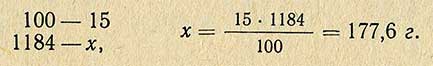
Следовательно, необходимое количество хлористого натрия различно для приготовления 1 кг и 1 л раствора. В тех случаях, когда приготовляют растворы из реактивов, содержащих в составе кристаллизационную воду, следует ее учитывать при расчете необходимого количества реактива.
Пример. Необходимо приготовить 1000 мл 5%-ного раствора Na2CO3 плотностью 1,050 из соли, содержащей кристаллизационную воду (Na2CO3-10H2O)
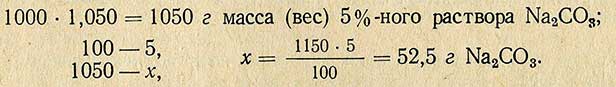
Молекулярная масса (вес) Na2CO3 равна 106 г, молекулярная масса (вес) Na2CO3-10H2O равна 286 г, отсюда рассчитывают необходимое количество Na2CO3-10H2O для приготовления 5%-ного раствора:
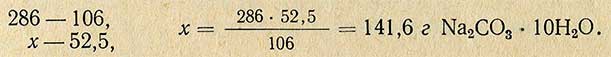
Методом разбавления растворы приготовляют следующим образом.
Пример. Необходимо приготовить 1 л 10%-ного раствора HCl из раствора кислоты относительной плотностью 1,185 (37,3%). Относительная плотность 10%-ного раствора 1,047 (по справочной таблице), следовательно, масса (вес) 1 л такого раствора равна 1000X1,047 = 1047 г. В этом количестве раствора должно содержаться чистого хлористого водорода
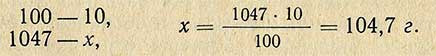
Чтобы определить, сколько необходимо взять 37,3%-ной кислоты, составляем пропорцию:
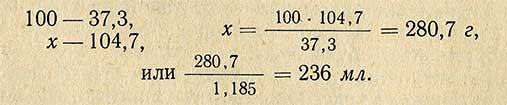
При приготовлении растворов путем разбавления или смешивания двух растворов для упрощения расчетов применяют способ диагональной схемы или «правило креста». На пересечении двух линий пишется заданная концентрация, а у обоих концов слева – концентрация исходных растворов, для растворителя она равна нулю.
Способы приготовления растворов заданной концентрации
Приготовление растворов заданной массовой концентрации растворенного вещества. Растворы готовят в специальной мерной посуде: мерных колбах, мерных цилиндрах, градуированных стаканах (рис. 1, 2).
С помощью технических или аналитических весов (в зависимости от заданной точности приготовления) отвешивают расчетное количество твердого вещества, переносят в мерную посуду, растворяют в небольшом количестве воды и доливают дистиллированную воду до отметки заданного объема (доводят до метки). Растворы можно готовить также разбавлением более концентрированных растворов.
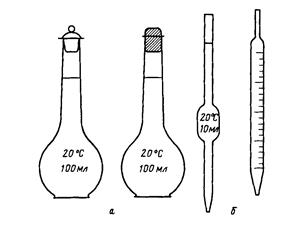
Рис. 1. Мерные колбы (а), пипетки (б)

Рис. 2. Мерный цилиндр (а), мерный стакан (мензурка) (б)
Пример 1. Приготовить 0,5 дм 3 15 г/дм 3 раствора гидроксида натрия. Рассчитаем массу вещества по уравнению (1)
 г
г
Навеску 7,5 г растворяем в мерной колбе на 500 см 3 .
Приготовление растворов с заданной массовой долей. Растворы готовят в химически стойкой посуде без градуировки объема. С помощью технических или аналитических весов отвешивают расчетное количество твердого вещества, переносят в мерную посуду и растворяют в расчетном количестве воды. Такие растворы можно готовить разбавлением концентрированных или смешением концентрированных и более разбавленных (или воды) растворов.
Пример 2. Приготовить 500 г 5% раствора гидроксида натрия. По уравнению (2) рассчитаем массу NaOH

Масса воды равна
 .
.
Таким образом, для приготовления раствора надо растворить 25 г твердого NaOH в 475 г воды.
Пример 3. Приготовить 3 кг 30% раствора серной кислоты из 95% и 10% раствора. Для приготовления необходимо рассчитать массы обоих растворов. Ранее для этого рекомендовали использовать правило «креста», в настоящее время с развитием вычислительной техники проще решить систему двух уравнений или воспользоваться готовой формулой. Введем обозначения x – необходимая масса 95% кислоты; y – необходимая масса 10% кислоты; m – масса конечного раствора, С%(1) – массовая доля 95% кислоты; С%(2) – массовая доля 10% кислоты; С%(к) – массовая доля приготовляемой кислоты.
Сумма масс кислоты в исходных растворах равна массе кислоты в конечном растворе, сумма масс растворов исходных кислот равна массе приготовляемой кислоты. Тогда получим систему из двух уравнений
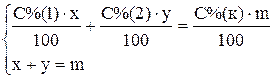 .
.
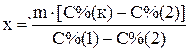 ;
; 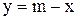 .
.
Подставив численные значения, получим:
х = 706 г; y = 2294 г.
Часто удобнее пользоваться не массой, а объемом растворов. В этом случае по справочнику определяют плотность исходных растворов и рассчитывают их объемы:
Для 95% кислоты  ;
; 
Для 10% кислоты  ;
;  .
.
Таким образом, для приготовления 3 кг 30% раствора серной кислоты необходимо отмерить 385 см 3 95% кислоты и прибавить 2152 см 3 10% кислоты.
Если в качестве второго раствора берут чистую воду, то принимают С%(2) = 0.
Приготовление растворов с заданной молярной концентрацией или молярной концентрацией эквивалента. Растворы готовят в специальной мерной посуде: мерных колбах, мерных цилиндрах (рис. 1, 2). С помощью технических или аналитических весов отвешивают расчетное количество твердого вещества, переносят в мерную посуду, растворяют в небольшом количестве воды и доливают дистиллированную воду до отметки заданного объема (доводят до метки). Такие растворы можно готовить также разбавлением более концентрированных растворов.
Пример 4. Приготовить 250 см 3 раствора NaOH с концентрацией 0,5 н из 10% раствора, r = 1,11 г/см 3 .
Массу NaOH, необходимую для приготовления раствора рассчитаем из уравнения (3)

Такая же масса NaOH должна содержаться в пробе 10% раствора
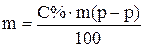
Приравняв правые части уравнений получим
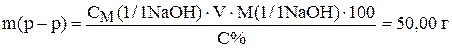 .
.
Рассчитаем объем раствора
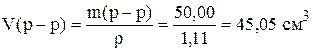 .
.
Таким образом, для приготовления раствора необходимо в мерную колбу на 250 см 3 отмерить 45,05 см 3 раствора NaOH с концентрацией 10%, довести до метки дистиллированной водой, и перемешать.
109.201.137.33 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Как приготовить 3% раствор медного купороса?
Как сделать 3 процентный раствор медного купороса?
Приготовить 3% раствор медного купороса очень просто. Что такое, в конечном итоге, представляет из себя этот состав? 3 весовых части самого медного купороса и 97 частей воды. Танцевать надо от нужного количества конечного раствора. Если его требуется 100 граммов, то надо взять 97 граммов воды, всыпать в эту воду 3 грамма медного купороса в порошке и тщательно размешать. В итоге получится 100 граммов искомого 3% раствора. Если нужен литр раствора, то количество составных частей надо, соответственно, увеличить в 10 раз, то есть порошка взять 30 граммов и растворить его в 970 граммов воды. Точно так же можно пересчитать нужное количество воды и порошка для любого количества конечного продукта.
![]()
Приготовление 3 раствора медного купороса
Раствор медного купороса (сульфата меди II) широко применяется в садоводстве и огородничестве в качестве удобрения, антисептика, для борьбы с грибковыми болезнями растений.
Используются различные концентрации раствора медного купороса: от слабой 0,5 – 1% (или даже меньше) до сильно концентрированной 3 – 5%.
В нашем случае речь идёт о растворе 3%, имеющем сильную концентрацию.
Как его приготовить?
1) Сначала нужно определиться, сколько литров раствора вам нужно, и исходя из этого брать определённое количество медного купороса и воды.
для 10 литров раствора нужно взять 300 грамм купороса и 10 литров воды.
для 15 литров раствора нужно взять 450 грамм купороса и 15 литров воды.
для 20 литров раствора нужно взять 600 грамм купороса и 20 литров воды.
2) Тара не должна быть металлической (можно использовать, например, пластиковую ёмкость), иначе пойдёт процесс окисления.
3) Для того, чтобы кристаллы медного купороса хорошо растворились в воде, нужно сначала залить их небольшим количеством тёплой воды (например, для 300 грамм кристаллов – это примерно 0,5 – 1 литр) и им дать раствориться (для этого можно вращать ёмкость по кругу).
4) Затем нужно долить оставшийся объём воды (желательно тёплой) и всё тщательно перемешать.
5) Раствор нужно применять в тот же день.
Разумеется, что при приготовлении нужно соблюдать меры безопасности: готовить раствор в саду / огороде, а не на кухне; надевать перчатки и защитную маску, не заниматься этим в дождливую (влажную) погоду.
Источники:
http://www.spec-kniga.ru/tehnohimicheski-kontrol/tekhnohimicheskij-kontrol-ovoshchesushilnogo-i-pishchekoncentratnogo-proizvodstva/rastvory-procentnoj-koncentracii.html
http://studopedia.ru/10_136294_sposobi-prigotovleniya-rastvorov-zadannoy-kontsentratsii.html
http://www.bolshoyvopros.ru/questions/3095715-kak-prigotovit-3-rastvor-mednogo-kuporosa.html