Как сделать ацетат натрия в домашних условиях
Ацетат натрия (свойства и применение)
Это химическое вещество многие знают под бытовым названием «горячий лед». На самом деле, ацетат натрия (C2H3O2Na) представляет собой искусственные кристаллы тех солей, которые входят в состав уксусной кислоты. Данное вещество широко распространено в природе. Оно имеется в составе многих клеток растительного и животного происхождения, поэтому ацетат натрия можно обнаружить во многих фруктах и ягодах. Также его образование происходит в ходе бактериальной ферментации, что приводит к его появлению в кисломолочных продуктах.
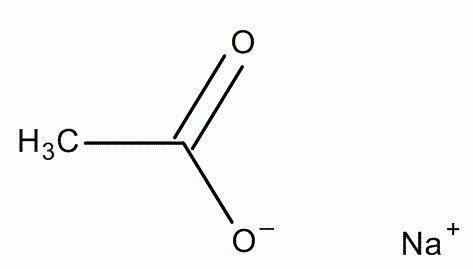
Свойства химического вещества
Ацетат натрия не без основания назвали «горячим льдом», поскольку в экзотермическом процессе кристаллизации он сильно нагревается. Это вещество имеет кристаллическую структуру. Оно практически бесцветно и имеет слабо выраженный запах уксусной кислоты. Его кристаллы обладают отличительной чертой: в эфире и спирте они очень плохо растворяются, а вот во время взаимодействия с водой они очень быстро превращаются в раствор ацетата натрия. Так, 76 г этого вещества растворяется в 100 мл H2O. Ацетат натрия обладает низким уровнем токсичности и не горюч. Удельная теплота его плавления составляет 264-289 к, а температура разложения: 324 °C. Ацетат натрия, тригидрат которого имеет точку плавления 58 °C, при нагревании до 100 °C в емкости, находящейся к кипятке, растворяется в своей кристаллизационной воде (расплавляется). Таким образом, он преобразуется в раствор. При его охлаждении наблюдается перенасыщение этого вещества в воде. Такой раствор замечательно переохлаждается до температуры 20-24 °C без образования его твердой фазы. После нажатия на металл в емкости происходит образование центра кристаллизации. В процессе роста он заставляет этот раствор преобразовываться в твердую фазу тригидрата натриевого ацетата. Этот процесс сопровождает значительное выделение тепла (264-289 кДж/кг).
Способы получения ацетата натрия

Как сделать ацетат натрия в домашних условиях

- NaHCO3 + CH3COOH = CH3COONa + H2CO3.
Другими словами, получение ацетата в домашних условиях называют «гашением соды». В результате этой химической реакции получается нестойкое соединение, моментально разлагающееся на воду и углекислый газ. Во время выпаривания получившегося раствора образуется кристаллический ацетат натрия. Как правило, для его получения берут соду и кислоту в соотношениях: 84 г гидрокарбоната натрия с 750 г винного уксуса (8%) или с 86 г уксусной эссенции (70%). В последнем случае выпаривание не понадобится. В результате реакции получается около 80 г ацетата натрия.
Другие названия ацетата натрия
Чаще всего для обозначения данного вещества используют такие его синонимы: натриевая соль уксусной кислоты, натриевый ацетат, натрия этаноат.

Применение ацетата натрия в качестве пищевой добавки
Данное вещество применяют в различных отраслях. Так, в пищевой промышленности его используют в качестве консерванта под обозначением Е262. На сегодняшний день производство некоторых продуктов питания без него не обходится. Так, ацетат натрия добавляют в муку для защиты хлебобулочных изделий от так называемой «картофельной болезни», вызываемой спорообразующими бактериями Bacillus mesentericus, очень распространенными в природе. При производстве чипсов также используют эту добавку для придания им приятного вкуса и аромата. Е262 добавляют и в овощные консервы, поскольку ее воздействие на продукты смягчает очень острый привкус уксусной кислоты. Многие люди очень настороженно относятся к различного рода пищевым добавкам. На самом деле, Е262 благодаря своей низкой токсичности разрешена к применению во всех европейских странах. В РФ также не устанавливалась максимальная ежедневная доза употребления ацетата натрия.
Использование в медицине
Также не редко использование данного вещества в медицинских целях. Оно имеется в составе многих лекарственных средств. Так, в частности, его можно обнаружить во многих мочегонных препаратах. Ацетаты натрия применяются в качестве ощелачивающих средств при матаболическом ацидозе и гипонатриемии.
Применение вещества в других отраслях

Помимо вышеперечисленных областей применения ацетат натрия используют в текстильной промышленности и строительстве. Данное вещество используется для нейтрализации уже отработанной серной кислоты, попадающей в сточные воды. Ацетат натрия применяют как фоторезист в процессе обработки тканей анилиновыми красителями. Он также используется в процессе дубления кож солями хрома (протравливание). Ацетат натрия во время производства синтетических резин замедляет вулканизацию хлоропрена. Его используют как противоморозную добавку для любых разновидностей бетона при производстве монолитных конструкций. Это вещество применяют в производстве так называемых «химических» обогревателей и грелок. Это обусловлено его способностью нагреваться до довольно высоких температур. Ацетат натрия является основным компонентом широко распространенной смеси под названием «горячий лед». Применяется это вещество и в производстве уксусного ангидрида, мыл, ацетилхлорида, ацетатов меди, винилацетата и других химикатов. Он используется как катализатор поликонденсации и компонент кислотных закрепителей для фотографий. Его применяют для получения электролитов и буферных растворов в гальванотехнике.

Негативные свойства вещества
Хотя ацетат натрия и малотоксичен, чрезмерное его употребление все-таки может нанести заметный ущерб здоровью человека. Так, его не рекомендуют людям, страдающим от таких заболеваний: артериальная гипертензия, вегето-сосудистая дистония, дисбактериоз. Следует значительно ограничить потребление продуктов, содержащих Е262 и тем, у кого наблюдаются проблемы с кишечником, мочевыводящими путями, печенью, желчным пузырем. Это обусловлено тем, что ацетат натрия в кишечники нередко превращается в токсичные нитраты, обладающие канцерогенным действием. Именно поэтому медики предупреждают о том, что чрезмерное потребление продуктов, содержащих Е262, может привести к образованию злокачественных опухолей, отравлениям и возникновению аллергических реакций. Ацетат натрия нельзя применять при производстве детских пищевых продуктов, поэтому наличие на упаковке маркировки Е262 является серьезной причиной отказа от их покупки.
Признаки отравления ацетатом натрия
К ним относятся: головокружение, головная боль, бледность кожи, острые болевые ощущения в животе, нарушение координации, затруднение дыхания, судороги, обмороки.
Взаимодействие ацетата натрия с другими веществами
Сочетание этого химиката с муравьиной кислотой дает аддукты. В результате его соединения с оксидом азота образуется нитрит натрия и уксусный ангидрит. Такие вещества, как ацетат натрия + концентрированная серная кислота, в соединении дают уксусную кислоту.
Опыт с получением натриевой соли уксусной кислоты или как сделать горячий лед (тригидрат ацетата натрия)
Тригидрат ацетата натрия представляет собой натриевую соль уксусной кислоты. Это основной ароматизатор в картофельных чипсах со вкусом соли и уксуса. В инструкции показан опыт как сделать ацетат натрия с использованием обычных бытовых ингредиентов.

Специального оборудования для измерения пропорций не требуется. Вы можете отмерять ингредиенты на глаз.
Примечание: ацетат натрия сильно пахнет и может вызвать раздражение глаз и кожи.
Эта инструкция не поможет сделать «горячий лед», т.к. здесь слишком много примесей.
Отказ от ответственности: я не несу ответственности за ущерб, вызванный неправильным использованием инструкции. Не предоставляю никаких выраженных или подразумеваемых гарантий. Все представлено здесь только для образовательных целей. Во время приготовления могут потребоваться защитные очки.
Шаг 1: Требуемые материалы

- бикарбонат натрия (пищевая сода)
- уксусная кислота
- стеклянные или керамические контейнеры, которые можно использовать в микроволновке
- фильтры для кофе
- ложка
Шаг 2: Химическая реакция



Положите немного соды в одну из емкостей. Я использовал мерную кружку и ложку. Начинайте медленно добавлять уксус. Если добавить слишком много, емкость переполнится пеной. Добавьте немного, дождитесь, пока пена сойдет, и добавьте еще чуть-чуть.
Продолжайте понемногу добавлять уксус, продолжая помешивать. Когда смесь перестанет пениться даже при перемешивании, остановитесь. У вас получился раствор ацетата натрия в воде. Моя мерная чашка почти наполнилась.
Шаг 3: Кипячение


Для выпаривания воды может помочь микроволновка. Мне потребовалось около 20 минут на высокой мощности. Я ставил три раза по пять минут, и в конце поставил еще на одну минуту.
Продолжайте выпаривать воду, пока не услышите шипящие звуки. Однако смесь все еще должна быть жидкой. Если вы вовремя не остановитесь, то у вас получится неприятный на запах желтый кусок.
Объем в результате должен быть примерно 1/10 от исходного.
Примечание: контейнер будет очень горячим.
Шаг 4: Охлаждение


На этом этапе вы должны получить очень насыщенный раствор ацетата натрия. Если вы всё сделали правильно, то, если дуть на поверхность, на ней будут появляться кристаллы.
Дайте смеси охладиться до комнатной температуры. Она должна образовать полупрозрачный гель.
Шаг 5: Сушка


Смешайте получившийся гель и кристаллы и перенесите их в маленькую миску с фильтром для кофе. Фильтр впитает оставшуюся влагу. Для ускорения процесса сушки гель можно разложить по частям в разные миски.
Шаг 6: Измельчение


Размельчите кусочки в порошок, используя ложку. Если порошок липкий, высыпьте его в фильтр для кофе, чтобы он еще просох. Теперь приготовление завершено. Порошок еще может содержать немного влаги, но это не страшно.

Рассказываю как сделать какую-либо вещь с пошаговыми фото и видео инструкциями.
Изготовление горячего льда или ацетата натрия
Опыт, который я проводил раньше, но наткнулся на него снова. Можно показывать фокусы близким, якобы одним прикосновением замораживая обычную воду. Жидкость кристаллизуется на глазах и очень похожа на воду! Провести опыт достаточно просто каждому мозгочину!

Начнем, пожалуй. Первое, и самое главное, что вам понадобится — это уксус, рекомендуемая концентрация 30% или 70%. Но если есть только 9%, не беда, пойдет и такой. Второй компонент — обычная столовая сода или гидрокарбонат натрия. Ну вот вы затарились кучей уксуса и соды, что же теперь делать дальше? А дальше вам надо вот что: вам нужны весы) Да без весов этот опыт скорее всего не удастся, так как химия — наука точная и не терпит методов «на глаз». Для начала вам необходимо отмерить компоненты — соду и уксус. Я рассчитал сколько нужно граммов соды для 200 мл бутылочки уксуса (именно в таких чаще всего продают уксус, а если нет, то обязательно ищите бутылочку на 200 мл уксуса) различной концентрации, вот мои результаты:
- Для 200 мл. уксуса 70% концентрации необходимо 210 грамм соды
- для 200 мл. уксуса 30% надо 87,4 грамм соды
- для 200 мл. уксуса 9% надо 25,25 грамм соды
Советую брать соды чуть меньше, так как выход этой реакции не 100%, а около 88-90%. Это потому, что в процессе выделения углекислого газа часть уксуса улетучивается. И для опыта советую брать электронные весы, так как с механическими возни не оберешься. Ну вот, вы отмерили количество соды и уксуса, теперь начинаем реакцию:
CH3COOH + NaHCO3 = CH3COONa + CO2 + H2O
Реакцию лучше проводить сразу в кастрюльке, немного нагревая смесь. Нагревать нужно, так как в ходе реакция температура смеси понижается и реакция замедляется. Только не надо ставить на газовую горелку, а то у вас там все пригорит. Имейте ввиду, что в ходе реакции образуется много пены. Ну вот, после того как реакция завершилась, раствор стал прозрачным испытайте вашу смесь: капните туда чуть-чуть уксуса, если реакция пойдет, это значит, что в растворе осталась лишняя сода. Добавляйте понемногу уксус, пока реакция не завершится. Также, если у вас раствор очень сильно пахнет уксусом, значит, в нем переизбыток уксусной кислоты. Можно немного добавить соды, чтобы при варке у вас не было вонищи по всему дому). Соду лучше добавлять по чуть-чуть, главное, чтобы запах уксуса не был таким сильным. На этом этапе очень важно, чтобы в растворе не было переизбытка соды, а то при следующем этапе у вас ничего не получится. Ну а если все уже нормально, и в растворе нет переизбытка соды и он не сильно воняет уксусом,, то смело ставьте ваш раствор на плиту и начинайте варить. Только не надо сразу забивать и идти смотреть зомбоящик или гамать в комп. Нет, за смесью надо следить!
В процессе варки или выпаривания из раствора улетучивается лишняя вода, поэтому процесс необходимо строго контролировать. Упаривать необходимо для получения перенасыщенного раствора ацетата натрия. Варить надо до появления по краям кастрюльки кристаллизационной корки. Время варки зависит от того, какой концентрации вы брали уксус.
Как только появилась корка, не тормозим и сразу снимаем кастрюльку с огня. И даем смеси чутка поостыть, минут так 5. После небольшого охлаждения кристаллизационная корка должна расшириться, и поверхность раствора должна покрыться как-бы «льдом». После этого кипятим в чайнике или в другой кастрюльке (если нету чайника) воду. Дальше берем в руки чайник и потихонечку, по капелькам добавляем в кастрюльку с нашей поостывшей смесью кипяток. Добавили чутка воды, отставили чайник, помешали раствор ложечкой. И так делаем до тех пор, пока весь «лед» и непонятные куски, плавающие в растворе не растворятся. В итоге должен получится горячий прозрачный, немного такой маслянистый раствор. Маслянистый, не в смысле жирный, а в смысле вязковатый или густоватый. Дальше вам понадобится какая-нибудь емкость типа баночки или кружки, только эта емкость должна быть идеально чистой. Это необходимо для того, чтоб раствор не кристаллизовался, пока охлаждается. Ну вот, взяли вы емкость, и выливаете туда горячий раствор из кастрюльки. Потом ставите емкость с раствором в холодильник. Раствор должен охладится как минимум до комнатной температуры. Ну а после того, как ацетат натрия охладился, то наступает момент истины: ИСПЫТАНИЕ!
Для этого возьмите щепотку столовой соли и сыпаните ее в ваш горячий лед. Если пошла кристаллизация, и ваше настроение улучшилось, то АЛИЛУЯ! Опыт удался! ВЫ сделали первый шаг на пути становления химиком!

А после кристаллизации этот горячий лед можно еще и повторно использовать! Для этого просто поставьте вашу емкость к кристаллизировавшимся ацетатом натрия на водяную баню. Помешивайте смесь ложечкой. Лед, как ему положено, будет таять. А если будет образовываться противная кристаллизационная корка, не злитесь, а по капелькам добавляйте кипяточек в ваш драгоценный горячий лед.

Очень интересный и красивый опыт — горячий лед:
- Что говорит нам WIKI: Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс). При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду), он расплавляется и переходит в водный раствор ацетата натрия. При охлаждении этого раствора ацетата натрия, он образует перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить назад в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция). При этом процессе выделяется около 264—289 кДж/кг (Теплота фазового перехода). Также ацетат натрия используется в некоторых моделях космических скафандров, как источник тепла.
Теперь, надеюсь вы без проблем получите ацетат натрия в домашних условиях и впечатлите окружающих своими познаниями и интересными опытами.
Источники:
http://www.syl.ru/article/141235/mod_atsetat-natriya-svoystva-i-primenenie
http://masterclub.online/topic/16032-atsetat-natriya














